Teori VSEPR digunakan untuk memprediksi bentuk molekul berdasarkan pasangan elektron yang mengelilingi atom pusatnya. Teori ini pertama kali dikemukakan oleh Sidgwick dan Powell pada tahun 1940. Teori VSEPR didasarkan pada asumsi bahwa molekul akan terbentuk sedemikian rupa sehingga tolakan elektron pada kulit valensi atom tersebut diminimalkan.
Daftar isi
- Postulat
- Keterbatasan
- Bentuk Molekul
- Apa Nomor VSEP?
- Teori VSEPR dan Bentuk Molekul
- Pertanyaan yang Sering Diajukan
Apa itu Teori VSEPR?
Teori Tolak-menolak Pasangan Elektron Kulit Valensi, disingkat teori VSEPR, didasarkan pada premis bahwa terdapat tolakan antara pasangan elektron valensi di semua atom, dan atom-atom akan selalu cenderung menyusun diri sedemikian rupa sehingga tolakan pasangan elektron ini diminimalkan. Susunan atom ini menentukan geometri molekul yang dihasilkan.
Geometri berbeda yang dapat diasumsikan oleh molekul sesuai dengan teori VSEPR dapat dilihat pada ilustrasi di bawah ini.
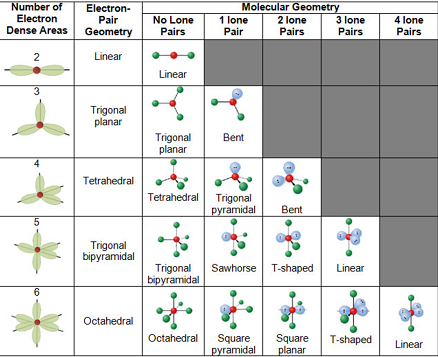
Teori VSEPR – Geometri Berbeda yang Dapat Diasumsikan oleh Molekul
Dua pendiri utama teori VSEPR adalah Ronald Nyholm dan Ronald Gillespie. Teori ini juga dikenal sebagai teori Gillespie-Nyholm untuk menghormati kedua ahli kimia tersebut.
Menurut teori VSEPR, tolakan antara dua elektron disebabkan oleh prinsip pengecualian Pauli , yang memiliki kepentingan lebih besar daripada tolakan elektrostatik dalam penentuan geometri molekul.
Postulat Teori VSEPR
Postulat teori VSEPR tercantum di bawah ini.
- Dalam molekul poliatomik (yakni, molekul yang tersusun atas tiga atom atau lebih), salah satu atom penyusunnya diidentifikasikan sebagai atom pusat yang mengikat semua atom lain dalam molekul tersebut .
- Jumlah total pasangan elektron kulit valensi menentukan bentuk molekul.
- Pasangan elektron memiliki kecenderungan untuk mengorientasikan diri sedemikian rupa sehingga meminimalkan tolakan elektron-elektron di antara mereka dan memaksimalkan jarak di antara mereka.
- Kulit valensi dapat dianggap sebagai bola di mana pasangan elektron terlokalisasi pada permukaan sedemikian rupa sehingga jarak di antara keduanya dimaksimalkan.
- Jika atom pusat molekul dikelilingi oleh pasangan elektron ikatan, maka bentuk molekulnya asimetris.
- Jika atom pusat dikelilingi oleh pasangan elektron bebas dan pasangan elektron ikatan, molekul akan cenderung memiliki bentuk yang terdistorsi.
- Teori VSEPR dapat diterapkan pada setiap struktur resonansi suatu molekul.
- Kekuatan tolak menolak paling kuat pada dua pasangan elektron bebas dan paling lemah pada dua pasangan ikatan.
- Jika pasangan elektron di sekitar atom pusat lebih dekat satu sama lain, mereka akan saling tolak. Hal ini mengakibatkan peningkatan energi molekul.
- Jika pasangan elektron terletak berjauhan satu sama lain, gaya tolak menolak di antara keduanya akan berkurang, dan akhirnya, energi molekul akan menjadi rendah.
Keterbatasan Teori VSEPR
Beberapa keterbatasan signifikan dari teori VSEPR meliputi:
- Teori ini gagal menjelaskan spesies isoelektronik (yaitu, unsur-unsur yang memiliki jumlah elektron yang sama). Spesies tersebut dapat bervariasi bentuknya, meskipun memiliki jumlah elektron yang sama.
- Teori VSEPR tidak menjelaskan senyawa logam transisi . Struktur beberapa senyawa tersebut tidak dapat dijelaskan dengan tepat oleh teori ini. Hal ini disebabkan oleh tidak memperhitungkan ukuran gugus substituen dan pasangan elektron bebas yang tidak aktif.
- Keterbatasan lain dari teori VSEPR adalah ia memprediksi bahwa halida unsur golongan 2 akan memiliki struktur linear, sedangkan struktur aktualnya adalah struktur bengkok.
Memprediksi Bentuk Molekul
Langkah-langkah berikut harus diikuti untuk menentukan bentuk suatu molekul.
- Atom yang paling tidak elektronegatif harus dipilih sebagai atom pusat (karena atom ini memiliki kemampuan tertinggi untuk berbagi elektron dengan atom lain yang termasuk dalam molekul).
- Jumlah total elektron yang termasuk dalam kulit terluar atom pusat harus dihitung.
- Jumlah total elektron yang dimiliki atom lain dan digunakan dalam ikatan dengan atom pusat harus dihitung.
- Kedua nilai ini harus ditambahkan untuk mendapatkan nomor pasangan elektron kulit valensi atau nomor VSEPR.
Apa Nomor VSEP?
Nomor VSEP menggambarkan bentuk molekul, seperti yang dijelaskan dalam tabel di bawah ini.
Masing-masing bentuk yang bersesuaian ini juga dapat ditemukan pada ilustrasi yang diberikan sebelumnya. Namun, teori VSEPR tidak dapat digunakan untuk mendapatkan sudut ikatan yang tepat antara atom-atom dalam suatu molekul.
Sekarang, kita akan membahas setiap bentuk secara rinci.
Bentuk Linear Molekul
- Dalam jenis molekul ini, kita menemukan dua tempat di kulit valensi atom pusat.
- Mereka harus diatur sedemikian rupa sehingga tolakan dapat diminimalkan (menunjuk ke arah yang berlawanan).
- Contoh: BeF 2
Bentuk Molekul Planar Trigonal
- Pada jenis molekul ini, kita menemukan tiga molekul yang terikat pada atom pusat.
- Mereka disusun sedemikian rupa sehingga tolakan antara elektron dapat diminimalkan (menuju sudut segitiga sama sisi ).
- Contoh: BF 3
Bentuk Molekul Tetrahedral
- Dalam molekul dua dimensi, atom-atom terletak pada bidang yang sama, dan jika kita menempatkan kondisi ini pada metana , kita akan mendapatkan geometri bidang persegi di mana sudut ikatan antara HCH adalah 90 0 .
- Sekarang, jika kita mempertimbangkan semua kondisi ini untuk molekul tiga dimensi, kita akan mendapatkan molekul tetrahedral di mana sudut ikatan antara HCH adalah 109 0 28' (ke arah sudut segitiga sama sisi) CH 4
Bentuk Molekul Trigonal Bipiramida
- Mari kita ambil contoh PF5 . Di sini, tolakan dapat diminimalkan dengan distribusi elektron yang merata di sudut piramida trigonal . Dalam bipiramida trigonal, tiga posisi terletak di sepanjang ekuator molekul. Kedua posisi tersebut terletak di sepanjang sumbu yang tegak lurus terhadap bidang ekuator.
Bagaimana Teori VSEPR Dapat Digunakan untuk Memprediksi Bentuk Molekul?
Kekuatan tolakan antara pasangan elektron bebas dan pasangan elektron ikatan terletak di antara tolakan antara dua pasangan elektron bebas dan dua pasangan elektron ikatan. Urutan tolakan antara pasangan elektron adalah sebagai berikut:
Pasangan Tunggal- pasangan tunggal > Pasangan Tunggal- pasangan ikatan > Pasangan Ikatan- pasangan ikatan
1. Jumlah total pasangan elektron di sekitar atom pusat = ½ (Jumlah elektron valensi atom pusat + Jumlah atom yang terikat pada atom pusat melalui ikatan tunggal)
- Untuk ion negatif, tambahkan jumlah elektron yang sama dengan satuan muatan negatif pada ion ke elektron valensi atom pusat.
- Untuk ion positif, kurangi jumlah elektron yang sama dengan satuan muatan positif pada ion dari elektron valensi atom pusat.
2. Jumlah pasangan ikatan = Jumlah total atom yang terikat pada atom pusat dengan ikatan tunggal.
3. Jumlah pasangan elektron bebas = Jumlah total elektron – Jumlah pasangan elektron bersama
Pasangan elektron di sekitar atom pusat saling tolak menolak dan bergerak begitu jauh sehingga tidak ada gaya tolak yang lebih besar di antara keduanya. Hal ini menghasilkan molekul dengan energi minimum dan stabilitas maksimum.
- Bentuk molekul dengan hanya dua atom selalu linear.
- Untuk molekul dengan tiga atom atau lebih, salah satu atom disebut atom pusat dan atom lainnya melekat pada atom pusat.
- Jika atom pusat terikat pada atom-atom serupa dan hanya dikelilingi oleh pasangan elektron ikatan, tolakan di antara keduanya serupa. Akibatnya, bentuk molekulnya simetris, dan molekul tersebut dikatakan memiliki geometri teratur.
- Jika atom pusat terikat dengan atom-atom lain atau dikelilingi oleh pasangan elektron ikatan, serta pasangan elektron bebas, gaya tolak-menolak di antara keduanya serupa. Akibatnya, bentuk molekul memiliki geometri yang tidak teratur atau terdistorsi.
- Bentuk pasti molekul bergantung pada jumlah total pasangan elektron yang ada di sekitar atom pusat.
Apa premis teori VSEPR?
Tolakan yang terjadi antara pasangan elektron di kulit valensi menyebabkan atom-atom menyusun diri sedemikian rupa sehingga meminimalkan tolakan ini. Hal ini secara langsung memengaruhi geometri molekul yang dibentuk oleh atom tersebut.
Apa bentuk molekulnya jika nomor VSEP adalah ?
Molekul tersebut akan memiliki struktur trigonal bipiramidal.
Apa keuntungan teori VSEPR?
Teori ini dapat digunakan untuk memprediksi bentuk molekul berbagai senyawa secara akurat. Setelah geometri molekul dipahami, reaksinya akan lebih mudah dipahami.
Baca Juga
Tidak ada komentar:
Posting Komentar