https://ecampusontario.pressbooks.pub/enhancedchemistry/chapter/lewis-symbols-structures/
11.3 Simbol Dan Struktur Lewis
Tujuan pembelajaran
Pada akhir bagian ini, Anda akan dapat:
- Tuliskan simbol Lewis untuk atom dan ion netral
- Gambarkan struktur Lewis yang menggambarkan ikatan dalam molekul sederhana
Sejauh ini dalam bab ini, kita telah membahas berbagai jenis ikatan yang terbentuk antara atom dan/atau ion. Dalam semua kasus, ikatan ini melibatkan pembagian atau transfer elektron kulit valensi antar atom. Di bagian ini, kita akan mengeksplorasi metode umum untuk menggambarkan elektron kulit valensi dan ikatan kimia, yaitu simbol Lewis dan struktur Lewis.
Simbol Lewis
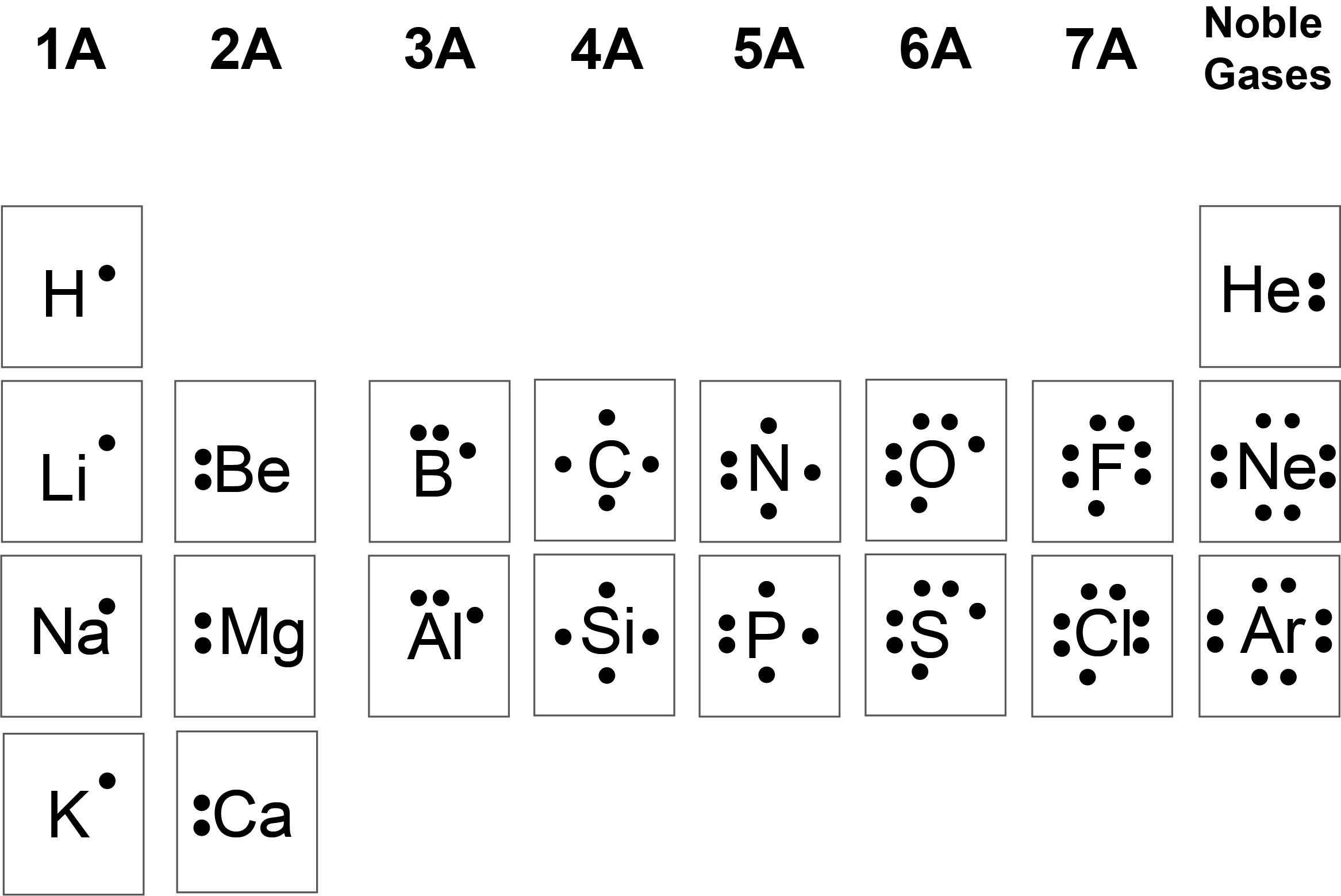
Kami menggunakan simbol Lewis untuk menggambarkan konfigurasi elektron valensi atom dan ion monoatomik. Simbol Lewis terdiri dari simbol unsur yang dikelilingi oleh satu titik untuk setiap elektron valensinya seperti yang ditunjukkan pada Gambar 11.3a.
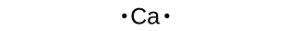
![Sebuah tabel ditampilkan yang memiliki tiga kolom dan sembilan baris. Baris tajuk bertuliskan "Atom," "Konfigurasi Elektronik," dan "Simbol Lewis." Kolom pertama berisi kata-kata "natrium," "magnesium," "aluminium," "silikon," "fosfor," "sulfur," "klorin," dan "argon." Kolom kedua berisi simbol dan angka "[ N e ] 3 s superskrip 2," "[ N e ] 3 s superskrip 2, 3 p superskrip 1," "[ N e ] 3 s superskrip 2, 3 p superskrip 2," "[ N e ] 3 s superskrip 2, 3 p superskrip 3," "[ N e ] 3 s superskrip 2, 3 p superskrip 4," "[ N e ] 3 s superskrip 2, 3 p superskrip 5," dan "[ N e ] 3 s superskrip 2, 3 p superskrip 6." Kolom ketiga berisi struktur Lewis untuk Na dengan satu titik, Mg dengan dua titik, Al dengan tiga titik, Si dengan empat titik, P dengan lima titik, S dengan enam titik, Cl dengan tujuh titik, dan Ar dengan delapan titik.](https://ecampusontario.pressbooks.pub/app/uploads/sites/3164/2023/03/CNX_Chem_07_03_3rowLewis.jpg)
Simbol Lewis juga dapat digunakan untuk menggambarkan pembentukan kation dari atom, seperti yang ditunjukkan di sini untuk natrium dan kalsium:

Demikian pula, mereka dapat digunakan untuk menunjukkan pembentukan anion dari atom, seperti yang ditunjukkan di sini untuk klorin dan sulfur:

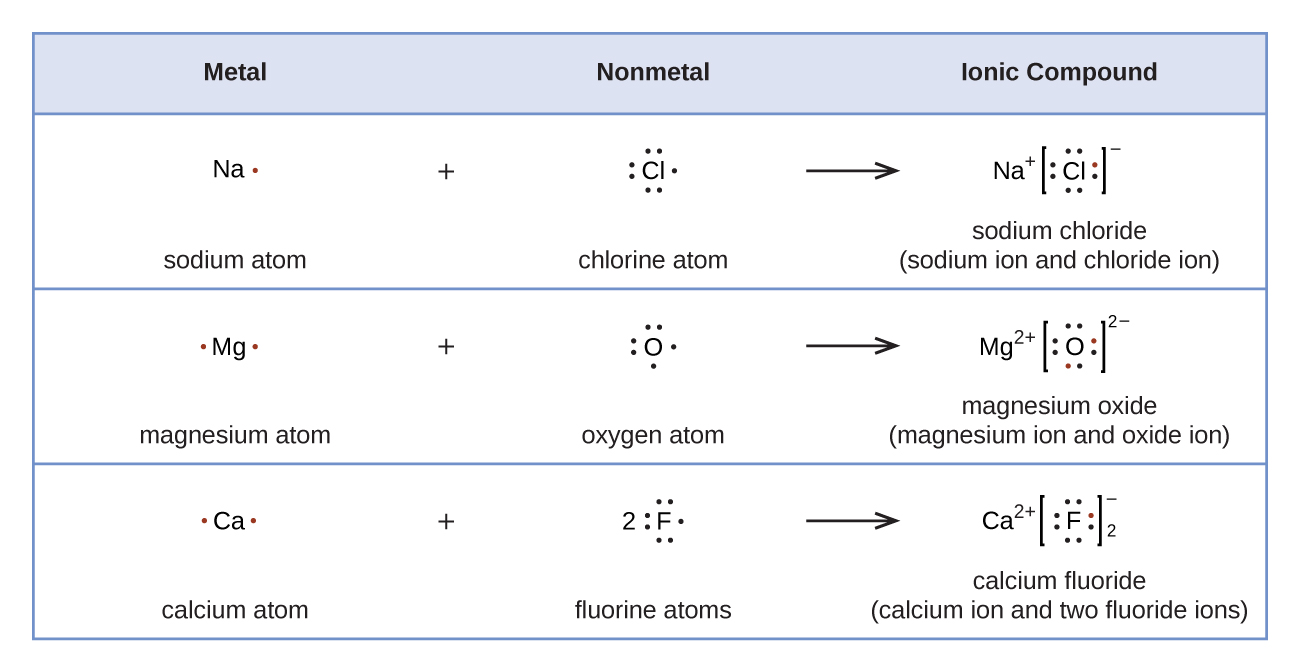
Gambar 11.3f menunjukkan penggunaan simbol Lewis untuk menunjukkan transfer elektron selama pembentukan senyawa ionik.
Struktur Lewis
Kami juga menggunakan simbol Lewis untuk menunjukkan pembentukan ikatan kovalen, yang ditunjukkan dalam struktur Lewis , gambar yang menggambarkan ikatan dalam molekul dan ion poliatomik. Misalnya, ketika dua atom klorin membentuk molekul klorin, mereka berbagi satu pasang elektron:
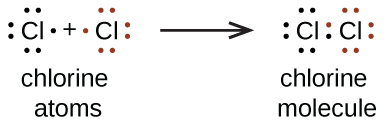
Struktur Lewis menunjukkan bahwa setiap atom Cl memiliki tiga pasang elektron yang tidak digunakan dalam ikatan (disebut pasangan elektron bebas ) dan satu pasang elektron bersama (ditulis di antara atom-atom). Tanda hubung (atau garis) terkadang digunakan untuk menunjukkan pasangan elektron bersama:

Sepasang elektron yang digunakan bersama disebut ikatan tunggal . Setiap atom Cl berinteraksi dengan delapan elektron valensi: enam pada pasangan elektron bebas dan dua pada ikatan tunggal.
Aturan Oktet
Molekul halogen lainnya (F2 , Br2 , I2 , dan At2 ) membentuk ikatan seperti yang terdapat pada molekul klorin: satu ikatan tunggal antar atom dan tiga pasangan elektron bebas per atom. Hal ini memungkinkan setiap atom halogen memiliki konfigurasi elektron gas mulia. Kecenderungan atom golongan utama untuk membentuk ikatan yang cukup untuk memperoleh delapan elektron valensi dikenal sebagai aturan oktet .
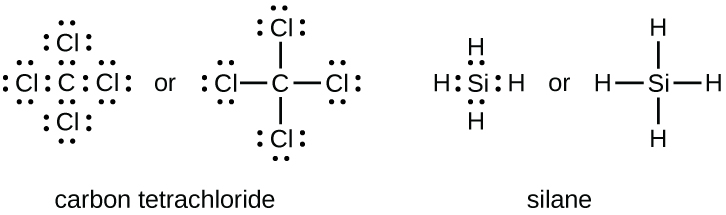
Jumlah ikatan yang dapat dibentuk suatu atom seringkali dapat diprediksi dari jumlah elektron yang dibutuhkan untuk mencapai oktet (delapan elektron valensi); hal ini terutama berlaku untuk nonlogam pada periode kedua tabel periodik (C, N, O, dan F). Sebagai contoh, setiap atom unsur golongan 14 memiliki empat elektron pada kulit terluarnya sehingga membutuhkan empat elektron lagi untuk mencapai oktet. Keempat elektron ini dapat diperoleh dengan membentuk empat ikatan kovalen, seperti yang diilustrasikan di sini untuk karbon dalam CCl₂ ( karbon tetraklorida) dan silikon dalam SiH₂ ( silana). Karena hidrogen hanya membutuhkan dua elektron untuk mengisi kulit valensinya, ia merupakan pengecualian terhadap aturan oktet. Unsur transisi dan unsur transisi dalam juga tidak mengikuti aturan oktet:
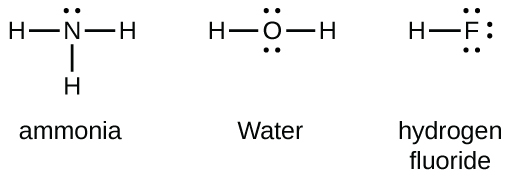
Unsur-unsur golongan 15 seperti nitrogen memiliki lima elektron valensi dalam simbol Lewis atom: satu pasangan elektron bebas dan tiga elektron tidak berpasangan. Untuk mencapai oktet, atom-atom ini membentuk tiga ikatan kovalen, seperti pada NH₂ ( amonia). Oksigen dan atom-atom lain dalam golongan 16 mencapai oktet dengan membentuk dua ikatan kovalen:
Ikatan Ganda dan Ikatan Rangkap Tiga
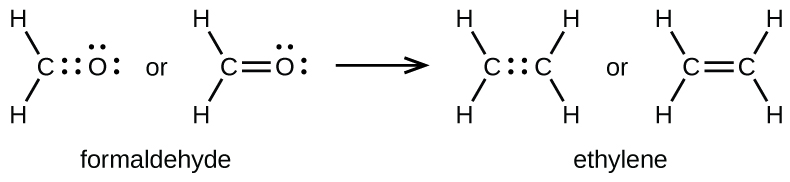
Sebagaimana telah disebutkan sebelumnya, ketika sepasang atom berbagi satu pasang elektron, kita menyebutnya ikatan tunggal. Namun, sepasang atom mungkin perlu berbagi lebih dari satu pasang elektron untuk mencapai oktet yang dibutuhkan. Ikatan rangkap terbentuk ketika dua pasang elektron dibagikan di antara sepasang atom, misalnya antara atom karbon dan oksigen dalam CH₂O ( formaldehida) dan antara dua atom karbon dalam C₂H₂ ( etilena ):
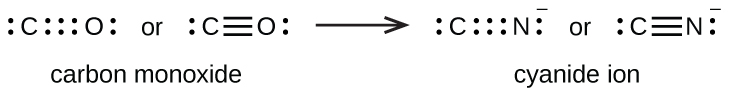
Ikatan rangkap tiga terbentuk ketika tiga pasang elektron digunakan bersama oleh sepasang atom, seperti pada karbon monoksida (CO) dan ion sianida (CN – ):
Menulis Struktur Lewis dengan Aturan Oktet
Untuk molekul dan ion molekul yang sangat sederhana, kita dapat menuliskan struktur Lewis hanya dengan memasangkan elektron yang tidak berpasangan pada atom-atom penyusunnya (Gambar 11.3m):
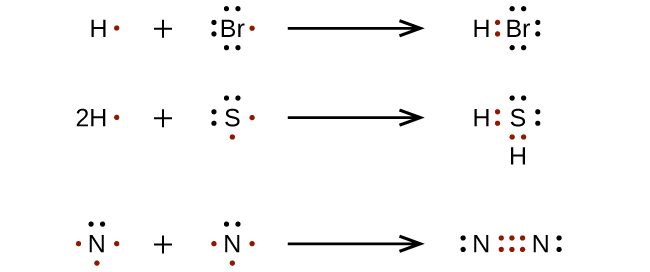
Untuk molekul dan ion molekul yang lebih rumit, akan sangat membantu jika mengikuti prosedur langkah demi langkah yang diuraikan di sini:
- Tentukan jumlah total elektron valensi (kulit terluar). Untuk kation, kurangi satu elektron untuk setiap muatan positif. Untuk anion, tambahkan satu elektron untuk setiap muatan negatif.
- Gambarlah struktur kerangka molekul atau ion, dengan menyusun atom-atom di sekitar atom pusat. (Umumnya, unsur yang paling elektronegatif harus ditempatkan di tengah.) Hubungkan setiap atom ke atom pusat dengan ikatan tunggal (satu pasangan elektron).
- Distribusikan elektron yang tersisa sebagai pasangan elektron bebas pada atom terminal (kecuali hidrogen), melengkapi oktet di sekitar setiap atom.
- Tempatkan semua elektron yang tersisa pada atom pusat.
- Susun ulang elektron atom terluar untuk membuat ikatan rangkap dengan atom pusat guna memperoleh oktet jika memungkinkan.
Mari kita tentukan struktur Lewis dari SiH 4 , CHO 2 −, NO + , dan OF 2 sebagai contoh dengan mengikuti prosedur ini:
- Tentukan jumlah total elektron valensi (kulit terluar) dalam molekul atau ion.
- Untuk suatu molekul, kita menambahkan jumlah elektron valensi pada setiap atom dalam molekul tersebut:
- Untuk ion negatif , seperti CHO 2 − , kita menambahkan jumlah elektron valensi pada atom dengan jumlah muatan negatif pada ion (satu elektron diperoleh untuk setiap muatan negatif tunggal):
- Untuk ion positif , seperti NO + , kita menambahkan jumlah elektron valensi pada atom-atom dalam ion dan kemudian mengurangi jumlah muatan positif pada ion (satu elektron hilang untuk setiap muatan positif tunggal) dari jumlah total elektron valensi:
- Karena OF 2 adalah molekul netral, kita cukup menambahkan jumlah elektron valensi:
- Untuk suatu molekul, kita menambahkan jumlah elektron valensi pada setiap atom dalam molekul tersebut:
- Gambarlah struktur kerangka molekul atau ion, susun atom-atom di sekitar atom pusat dan hubungkan setiap atom ke atom pusat dengan ikatan tunggal (satu pasangan elektron). (Perhatikan bahwa kami menandai ion dengan tanda kurung di sekitar struktur, yang menunjukkan muatan di luar tanda kurung:)
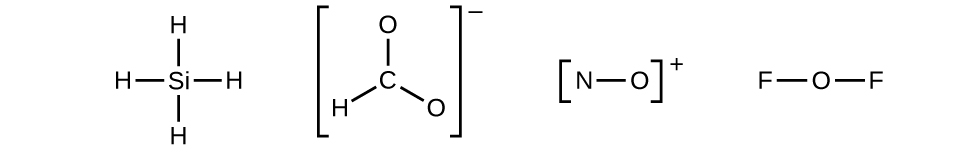
Gambar 11.3n: Struktur rangka (struktur Lewis tidak lengkap) dari SiH 4 , CHO 2 − , NO + , dan OF 2 . Langkah 2 dari proses menggambar struktur Lewis (kredit: Chemistry (OpenStax) , CC BY 4.0 ). Ketika beberapa susunan atom dimungkinkan, seperti pada CHO 2 − , kita harus menggunakan bukti eksperimental untuk memilih susunan yang tepat. Secara umum, unsur yang kurang elektronegatif lebih mungkin menjadi atom pusat. Pada CHO 2 − , atom karbon yang kurang elektronegatif menempati posisi pusat dengan atom oksigen dan hidrogen mengelilinginya. Contoh lain termasuk P pada POCl 3 , S pada SO 2 , dan Cl pada ClO 4 − . Pengecualiannya adalah hidrogen hampir tidak pernah menjadi atom pusat. Sebagai unsur yang paling elektronegatif, fluor juga tidak dapat menjadi atom pusat.
- Distribusikan elektron yang tersisa sebagai pasangan elektron bebas pada atom terminal (kecuali hidrogen) untuk melengkapi kulit valensinya dengan oktet elektron.
- Tidak ada elektron tersisa pada SiH 4 , jadi tidak berubah:
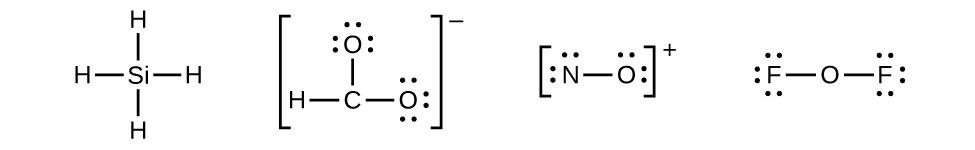
Gambar 11.3o: Struktur Lewis SiH 4 . Struktur rangka (struktur Lewis tidak lengkap) dari CHO 2 − , NO + , dan OF 2 . Langkah 3 dari proses menggambar struktur Lewis (kredit: Chemistry (OpenStax) , CC BY 4.0 ).
- Tidak ada elektron tersisa pada SiH 4 , jadi tidak berubah:
- Tempatkan semua elektron yang tersisa pada atom pusat.
- Untuk SiH 4 , CHO 2 − , dan NO + , tidak ada elektron yang tersisa; kami telah menempatkan semua elektron yang ditentukan pada Langkah 1.
- Untuk OF 2 , kita memiliki 16 elektron tersisa di Langkah 3, dan kita menempatkan 12, menyisakan 4 untuk ditempatkan pada atom pusat:
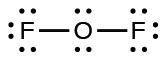
Gambar 11.3p: Struktur Lewis OF 2. Langkah 4 dari proses menggambar struktur Lewis (kredit: Chemistry (OpenStax) , CC BY 4.0 ).
- Susun ulang elektron atom terluar untuk membuat ikatan rangkap dengan atom pusat guna memperoleh oktet jika memungkinkan.
- SiH 4 : Si sudah memiliki oktet, jadi tidak ada yang perlu dilakukan.
- CHO 2 − : Kami telah mendistribusikan elektron valensi sebagai pasangan elektron bebas pada atom oksigen, tetapi atom karbon tidak memiliki oktet:
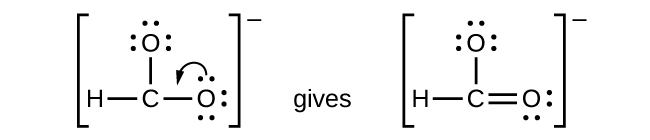
Gambar 11.3q: Struktur Lewis CHO 2 − . Langkah ke-5 proses menggambar struktur Lewis (kredit: Chemistry (OpenStax) , CC BY 4.0 ). - NO + : Untuk ion ini, kita menambahkan delapan elektron valensi, tetapi tidak ada atom yang memiliki oktet. Kita tidak dapat menambahkan elektron lagi karena kita telah menggunakan total yang kita temukan pada Langkah 1, jadi kita harus memindahkan elektron untuk membentuk ikatan rangkap:
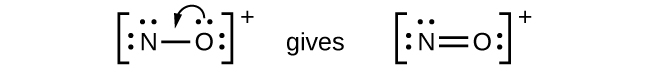
Gambar 11.3r: Struktur Lewis tidak lengkap NO + . Langkah ke-5 dari proses menggambar struktur Lewis (kredit: Chemistry (OpenStax) , CC BY 4.0 ). - Ini masih belum menghasilkan oktet, jadi kita harus memindahkan pasangan lain, membentuk ikatan rangkap tiga:
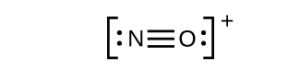
Gambar 11.3: Struktur Lewis NO + . Langkah ke-5 proses menggambar struktur Lewis (kredit: Chemistry (OpenStax) , CC BY 4.0 ). - Dalam OF 2 , setiap atom memiliki oktet seperti yang digambar, jadi tidak ada yang berubah.
Contoh 11.3a
Menulis Struktur Lewis
Misi Cassini-Huygens NASA mendeteksi awan besar hidrogen sianida (HCN) beracun di Titan, salah satu bulan Saturnus. Titan juga mengandung etana (H₂CCH₂ ) , asetilena (HCCH₂), dan amonia (NH₂ ) . Bagaimana struktur Lewis molekul-molekul ini?
Larutan
- Hitung jumlah elektron valensi.
- HCN: (1 × 1) + (4 × 1) + (5 × 1) = 10
- H 3 CCH 3 : (1 × 3) + (2 × 4) + (1 × 3) = 14
- HCCH: (1 × 1) + (2 × 4) + (1 × 1) = 10
- NH3 : (5 × 1) + (3 × 1) = 8
- Gambarlah kerangka dan hubungkan atom-atom dengan ikatan tunggal. Ingat bahwa H tidak pernah menjadi atom pusat:
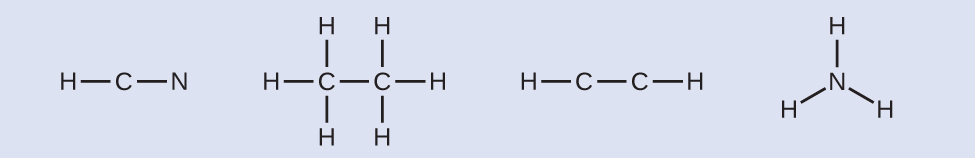
- Jika diperlukan, distribusikan elektron ke atom terminal:
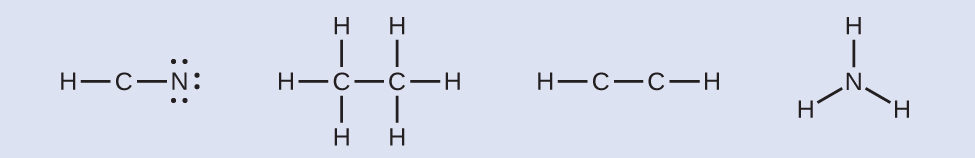
- HCN: enam elektron ditempatkan pada N.
- H 3 CCH 3 : tidak ada elektron yang tersisa.
- HCCH: tidak ada atom terminal yang mampu menerima elektron.
- NH3 : tidak ada atom terminal yang mampu menerima elektron.
- Jika diperlukan, tempatkan elektron yang tersisa pada atom pusat:
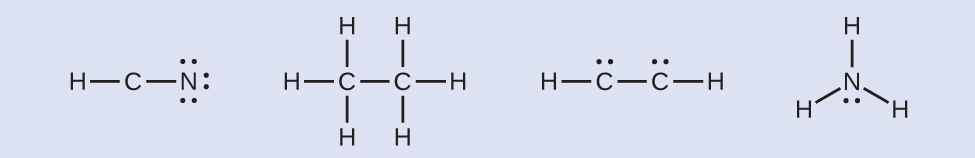
- HCN: tidak ada elektron yang tersisa.
- H 3 CCH 3 : tidak ada elektron yang tersisa.
- HCCH: empat elektron ditempatkan pada karbon.
- NH3 : dua elektron ditempatkan pada nitrogen.
- Jika diperlukan, susun ulang elektron untuk membentuk beberapa ikatan guna memperoleh oktet pada setiap atom:
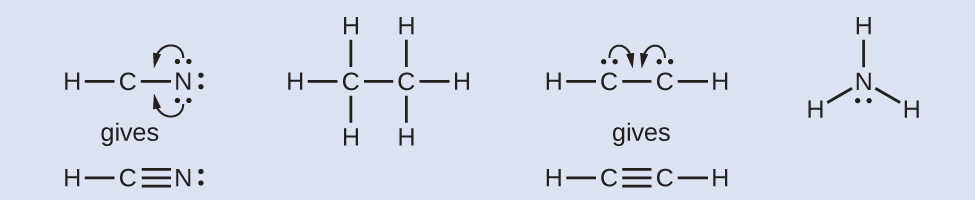
- HCN: membentuk dua ikatan C–N lagi.
- H 3 CCH 3 : semua atom memiliki jumlah elektron yang tepat.
- HCCH: membentuk ikatan rangkap tiga antara dua atom karbon.
- NH3 : semua atom memiliki jumlah elektron yang benar .
Latihan 11.3a
Karbon monoksida, CO, dan karbon dioksida, CO2, keduanya merupakan produk pembakaran bahan bakar fosil. Kedua gas ini juga menimbulkan masalah: CO bersifat toksik dan CO2 telah dikaitkan dengan perubahan iklim global. Bagaimana struktur Lewis kedua molekul ini?
Periksa Jawaban Anda [1]

Kimia Fullerene
Jelaga karbon telah dikenal manusia sejak zaman prasejarah, tetapi baru-baru ini struktur molekul komponen utama jelaga ditemukan. Pada tahun 1996, Hadiah Nobel dalam Kimia dianugerahkan kepada Richard Smalley (Gambar 11.3t), Robert Curl, dan Harold Kroto atas karya mereka dalam menemukan bentuk karbon baru, molekul C 60 buckminsterfullerene ( Gambar 11.a dalam Bab 11 Pendahuluan ). Seluruh kelas senyawa, termasuk bola dan tabung dengan berbagai bentuk, ditemukan berdasarkan C 60. Jenis molekul ini, yang disebut fullerene, menunjukkan harapan dalam berbagai aplikasi. Karena ukuran dan bentuknya, fullerene dapat membungkus molekul lain, sehingga mereka telah menunjukkan potensi dalam berbagai aplikasi mulai dari penyimpanan hidrogen hingga sistem pengiriman obat yang ditargetkan. Mereka juga memiliki sifat elektronik dan optik yang unik yang telah digunakan dengan baik dalam perangkat bertenaga surya dan sensor kimia.
Richard Smalley (1943–2005), seorang profesor fisika, kimia, dan astronomi di Rice University, adalah salah satu pendukung utama kimia fullerene. Setelah kematiannya pada tahun 2005, Senat AS menganugerahinya gelar "Bapak Nanoteknologi".
Pelajari lebih lanjut tentang Dr. Smalley dengan membaca artikel Richard E. Smalley – Fakta [Tab Baru] di situs web Hadiah Nobel.
Ilmuwan Beraksi: Dr. Mario J. Molina

Dr. Mario J. Molina adalah seorang ahli kimia Meksiko yang terkenal karena perannya dalam penemuan dampak CFC (klorofluorokarbon) terhadap lapisan ozon. Ia merupakan salah satu penerima Hadiah Nobel Kimia pada tahun 1995.
Bagian dari karyanya termasuk hipotesis bahwa CFC di atmosfer atas dapat menghasilkan radikal klorin yang akan mengkatalisis kerusakan ozon.
Cl· + O 3 → ClO· + O 2
ClO· + O· → Cl· + O 2
Setelah data yang mengonfirmasi hipotesis ini terkumpul, berbagai negara di dunia mengambil langkah-langkah untuk menghentikan penggunaan senyawa perusak ozon. Tindakan paling signifikan dituangkan dalam Protokol Montreal [Tab Baru] .
Dr. Molina saat ini merupakan anggota fakultas di UC San Diego dan terlibat dalam penjangkauan sains.
Saksikan Dr. Molina menyampaikan pidatonya kepada para siswa mengenai inspirasinya untuk menjadi seorang ilmuwan dalam video Hadiah Nobel ini di YouTube [Tab Baru] .
Pengecualian terhadap Aturan Oktet
Banyak molekul kovalen memiliki atom pusat yang tidak memiliki delapan elektron dalam struktur Lewisnya. Molekul-molekul ini terbagi dalam tiga kategori:
- Molekul elektron ganjil memiliki jumlah elektron valensi ganjil, dan karena itu memiliki elektron yang tidak berpasangan.
- Molekul yang kekurangan elektron memiliki atom pusat yang memiliki lebih sedikit elektron daripada yang dibutuhkan untuk konfigurasi gas mulia.
- Molekul hipervalen memiliki atom pusat yang memiliki lebih banyak elektron daripada yang dibutuhkan untuk konfigurasi gas mulia.
Molekul Elektron Ganjil
Kita menyebut molekul yang mengandung elektron ganjil sebagai radikal bebas . Oksida nitrat, NO, adalah contoh molekul dengan elektron ganjil; molekul ini diproduksi dalam mesin pembakaran internal ketika oksigen dan nitrogen bereaksi pada suhu tinggi.
Untuk menggambar struktur Lewis untuk molekul elektron ganjil seperti NO, kita mengikuti lima langkah yang sama seperti yang kita lakukan untuk molekul lain, tetapi dengan beberapa perubahan kecil:
- Tentukan jumlah total elektron valensi (kulit terluar) . Jumlah elektron valensi adalah 5 (dari N) + 6 (dari O) = 11. Angka ganjil tersebut langsung menunjukkan adanya radikal bebas, sehingga kita tahu bahwa tidak setiap atom dapat memiliki delapan elektron di kulit valensinya.
- Gambarkan struktur kerangka molekulnya . Kita dapat dengan mudah menggambar kerangka dengan ikatan tunggal N–O: N–O
- Distribusikan elektron yang tersisa sebagai pasangan elektron bebas pada atom terminal . Dalam hal ini, tidak ada atom pusat, jadi kita distribusikan elektron di sekitar kedua atom. Kita memberikan delapan elektron kepada atom yang lebih elektronegatif dalam situasi ini; dengan demikian, oksigen memiliki kulit valensi yang terisi:
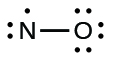
Gambar 11.3v: Struktur Lewis NO di mana oksigen diberi delapan elektron karena lebih elektronegatif dibandingkan dengan nitrogen (kredit: Chemistry (OpenStax) , CC BY 4.0 ). - Tempatkan semua elektron yang tersisa pada atom pusat . Karena tidak ada elektron yang tersisa, langkah ini tidak berlaku.
- Susun ulang elektron-elektron tersebut untuk membentuk ikatan rangkap dengan atom pusat guna mencapai oktet sedapat mungkin. Kita tahu bahwa molekul dengan elektron ganjil tidak dapat memiliki oktet untuk setiap atom, tetapi kita ingin agar setiap atom sedekat mungkin dengan oktet. Dalam hal ini, nitrogen hanya memiliki lima elektron di sekitarnya. Untuk mendekati oktet bagi nitrogen, kita ambil salah satu pasangan elektron bebas dari oksigen dan gunakan untuk membentuk ikatan rangkap NO. (Kita tidak dapat mengambil pasangan elektron bebas lain dari oksigen dan membentuk ikatan rangkap tiga karena nitrogen akan memiliki sembilan elektron :)
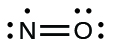
Gambar 11.3w: Struktur Lewis ikatan rangkap NO di mana elektron disusun ulang untuk memperoleh oktet di mana ikatan rangkap terbentuk sehingga nitrogen dapat bergerak lebih dekat ke oktet (kredit: Chemistry (OpenStax) , CC BY 4.0 ).
Molekul Kekurangan Elektron
Kita juga akan menemukan beberapa molekul yang mengandung atom pusat yang tidak memiliki kulit valensi yang terisi. Umumnya, ini adalah molekul dengan atom pusat dari golongan 2 dan 12, atom terluar yang berupa hidrogen, atau atom lain yang tidak membentuk ikatan rangkap. Misalnya, dalam struktur Lewis berilium dihidrida, BeH2 , dan boron trifluorida, BF3 , atom berilium dan boron masing-masing hanya memiliki empat dan enam elektron. Dimungkinkan untuk menggambar struktur dengan ikatan rangkap antara atom boron dan atom fluorin dalam BF3 , yang memenuhi aturan oktet, tetapi bukti eksperimental menunjukkan panjang ikatan lebih dekat dengan yang diharapkan untuk ikatan tunggal B–F. Ini menunjukkan struktur Lewis terbaik memiliki tiga ikatan tunggal B–F dan boron yang kekurangan elektron. Reaktivitas senyawa tersebut juga konsisten dengan boron yang kekurangan elektron. Namun, ikatan B–F sedikit lebih pendek daripada yang sebenarnya diharapkan untuk ikatan tunggal B–F, yang menunjukkan bahwa beberapa karakter ikatan rangkap ditemukan dalam molekul sebenarnya.
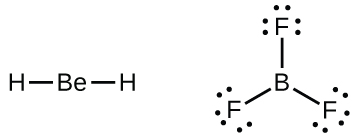
Atom seperti atom boron dalam BF3 , yang tidak memiliki delapan elektron, sangat reaktif. Atom ini mudah berikatan dengan molekul yang mengandung atom dengan pasangan elektron bebas. Misalnya, NH3 bereaksi dengan BF3 karena pasangan elektron bebas pada nitrogen dapat digunakan bersama oleh atom boron (Gambar 11.3y).
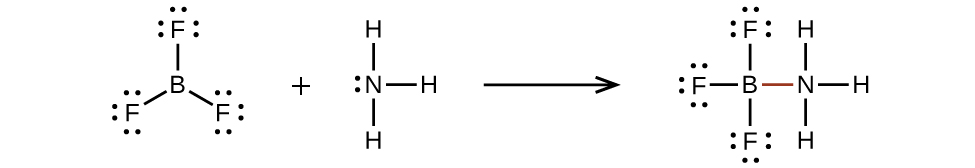
Molekul Hipervalen
Unsur-unsur pada periode kedua tabel periodik ( n = 2) hanya dapat menampung delapan elektron dalam orbital kulit valensinya karena hanya memiliki empat orbital valensi (satu orbital 2s dan tiga orbital 2p ) . Unsur-unsur pada periode ketiga dan lebih tinggi ( n ≥ 3) memiliki lebih dari empat orbital valensi dan dapat berbagi lebih dari empat pasang elektron dengan atom lain karena memiliki orbital d kosong pada kulit yang sama. Molekul yang terbentuk dari unsur-unsur ini terkadang disebut molekul hipervalen . Gambar 11.3z menunjukkan struktur Lewis untuk dua molekul hipervalen, PCl5 dan SF6 .
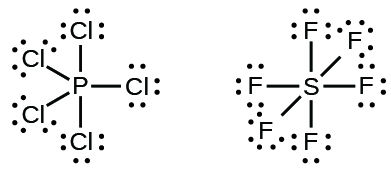
Pada beberapa molekul hipervalen, seperti IF5 dan XeF4 , beberapa elektron di kulit terluar atom pusat adalah pasangan elektron bebas (Gambar 11.3aa).
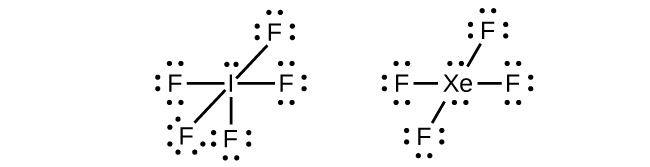
Ketika kita menuliskan struktur Lewis untuk molekul-molekul ini, kita menemukan bahwa terdapat elektron tersisa setelah mengisi kulit valensi atom terluar dengan delapan elektron. Elektron tambahan ini harus dialokasikan ke atom pusat.
Contoh 11.3b
Menulis Struktur Lewis: Pelanggaran Aturan Oktet
Xenon adalah gas mulia, tetapi membentuk sejumlah senyawa stabil. Kita telah membahas XeF⁻⁻ sebelumnya . Bagaimana struktur Lewis XeF⁻⁻⁻ dan XeF⁻⁻⁻ ?
Larutan
Kita dapat menggambar struktur Lewis molekul kovalen apa pun dengan mengikuti enam langkah yang telah dibahas sebelumnya. Dalam hal ini, kita dapat meringkas beberapa langkah terakhir, karena tidak semuanya berlaku.
- Hitunglah jumlah elektron valensi: XeF 2 : 8 + (2 × 7) = 22XeF 6 : 8 + (6 × 7) = 50
- Gambarlah kerangka yang menghubungkan atom-atom dengan ikatan tunggal. Xenon akan menjadi atom pusat karena fluorin tidak dapat menjadi atom pusat:
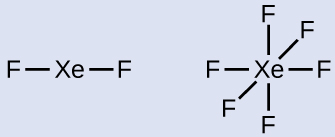
- Distribusikan elektron yang tersisa.
- XeF2 : Kita menempatkan tiga pasang elektron bebas di sekitar setiap atom F, yang berarti 12 elektron dan memberikan setiap atom F 8 elektron. Dengan demikian, tersisa enam elektron (tiga pasang elektron bebas). Pasangan elektron bebas ini harus ditempatkan pada atom Xe. Hal ini dapat diterima karena atom Xe memiliki orbital d kulit valensi yang kosong dan dapat menampung lebih dari delapan elektron. Struktur Lewis XeF2 menunjukkan dua pasangan elektron ikatan dan tiga pasang elektron bebas di sekitar atom Xe:
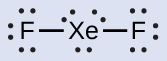
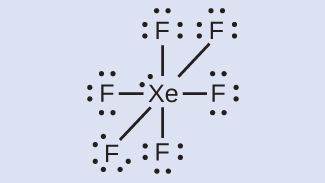
- XeF 6 : Kami menempatkan tiga pasang elektron bebas di sekitar setiap atom F, yang berarti totalnya 36 elektron. Dua elektron tersisa, dan pasangan elektron bebas ini ditempatkan pada atom Xe:
- XeF2 : Kita menempatkan tiga pasang elektron bebas di sekitar setiap atom F, yang berarti 12 elektron dan memberikan setiap atom F 8 elektron. Dengan demikian, tersisa enam elektron (tiga pasang elektron bebas). Pasangan elektron bebas ini harus ditempatkan pada atom Xe. Hal ini dapat diterima karena atom Xe memiliki orbital d kulit valensi yang kosong dan dapat menampung lebih dari delapan elektron. Struktur Lewis XeF2 menunjukkan dua pasangan elektron ikatan dan tiga pasang elektron bebas di sekitar atom Xe:
Latihan 11.3b
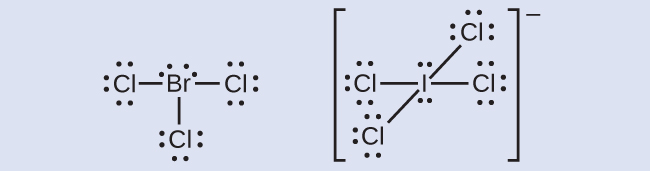
Halogen membentuk golongan senyawa yang disebut interhalogen, di mana atom-atom halogen berikatan secara kovalen satu sama lain. Tuliskan struktur Lewis untuk interhalogen BrCl⁻⁻⁻ dan ICl⁻⁻⁻⁻ .
Periksa Jawaban Anda [2]
Tautan ke Alat Pembelajaran Interaktif
Jelajahi Struktur Titik Elektron Lewis dari Kelas Fisika .
Jelajahi Menggambar Struktur Lewis dari Alchemie.
Atribusi & Referensi
Kecuali dinyatakan lain, halaman ini diadaptasi oleh JR van Haarlem dari " 4.4 Simbol dan Struktur Lewis " dalam Kimia Umum 1 & 2 oleh Rice University, turunan dari Chemistry (Open Stax) karya Paul Flowers, Klaus Theopold, Richard Langley & William R. Robinson, dan dilisensikan di bawah CC BY 4.0 . Akses gratis di Chemistry (OpenStax )